Kali ini saya akan membagikan jurnal laporan praktikum saya kepada kawan-kawan sekalian. semoga bermanfaat dan digunakan semestinya
BAB I
PENDAHULUAN
1.1 LATAR
BELAKANG
Untuk dapat
meneliti mikroorganisme di laboratorium kita harus dapat menumbuhkan
mikroorganisme tersebut . Mikroorganisme dapat berkembang secara alami
ataupun buatan. Substrat yang digunakan manusia dalam dalam mengembangkan dan menumbuhkan
mikroorganisme disebut media . Untuk itu harus dipahami jenis – jenis nutrien
yang diisyaratkan oleh bakteri dan lingkungan fisik yang menyediakan kondisi
optimum bagi pertumbuhannya. Alat – alat yang digunakan dalam perkembangbiakan
ini harus disterilkan terlebih dulu , supaya mikroorganisme yang tidak
diinginkan tidak tumbuh , sehingga menghambat pertumbuhan mikroorganisme (Dwijeseputro,
1998).
Inokulasi
dimaksudkan untuk menumbuhkan, meremajakan mikroba dan mendapatkan populasi
mikroba yang murni. Inokulasi adalah pekerjaan memindahkan bakteri dari medium
yang lama dengan tingkat ketelitian yang sangat tinggi . Agar biakan bakteri
dapat dibuat , maka alat – alat harus disterilisasi sebelum inokulasi .
Sterilisasi merupakan suatu proses untuk mematikan semua organisme yang
terdapat pada suatu benda . Proses sterilisasi dapat dibedakan menjadi tiga
macam yaitu , penggunaan panas ( pemijaran dan udara panas ) , penyaringan ,
penggunaan bahan kimia ( etilena oksida , asam perasetat , formal dehida dan
glutaraldehida alkalin ) (Dwijeseputro, 1998).
Pada
praktikum ini akan dilakukan teknik inokulasi biakan mikroorganisme pada medium
steril untuk mempelajari mikrobiologi dengan satu kultur murni saja.
Identifikasi biakan mikroorganisme seringkali memerlukanpemindahan
ke biakan segar tanpa terjadi pencemarann. Pemindahan mikroorganisme ini
dilakukan dengan teknik aseptik untuk mempertahankan kemurnian biakan selama
pemindahan berulangkali. Identifikasi biakan mikroorganisme seringkali
memerlukan pemindahan ke biakan segar tanpa terjadi pencemaran maka dari itu
perlu adanya sterilisasi untuk menjadikan alat-alat yang akan digunakan menjadi
steril. Pemindahan mikroorganisme ini dilakukan dengan teknik aseptik untuk
mempertahankan kemurnian biakan selama pemindahan berulangkali (Dwijeseputro,
1998).
1.2 Prinsip Percobaan
1.2.1
Sterilisasi
Ada dua macam cara yang
sering digunakan untuk sterilisasi, yaitu sterilisasi panas kering dengan
menggunakan oven pada suhu 170ºC selama 1 jam dan sterilisasi basah(uap) dengan
menggunakan autoklaf pada suhu 121 ºC selama 15 menit. Sterilisasi panas kering
dipakai untuk peralatan yang terbuat dari logam dan gelas,alat-alat kualitatif
dan untuk alat atau bahan-bahan yang tahan suhu tinggi. Sedangkan Sterilisasi
basah digunakan untuk peralatan yang terbuat dari plastik tahan panas,
karet,set peralatan logam, atau alat-alat kuantitatif yang kurang tahan
terhadap pemanasan.
1.1.1. Inokulasi
Pada percobaan
inokulasi yang dilakukan ada tiga metode, yaitu metode gores, metode sebar dan
metode tuang. Pada metode gores dan metode sebar Nutrien Agar di masukkan
terlebih dahulu kedalam cawan petri diikuti dengan sampel dengan cara digores
pada metode gores dan dengan cara di tetesi lalu di sebarkan pada metode sebar
hingga inokulum merata di permukaan media yang digunakan. Sedangkan pada metode
tuang sampel diletakkan terlebih dahulu lalu diikuti dengan penambahan Nutrien
Agar homogenkan sampel yang ada dengan cara dikocok membentuk angka 8 agar
inokulum yang berada didasar nutrisi tersebar merata dan tidak menggumpal lalu
petri ditutup. Petri di inkubasi selama 24 jam dan dilakukan pengamatan.
1.3 TUJUAN PERCOBAAN
1.3.1
Sterilisasi
-
Agar praktikan
mengetahui teknik sterilisasi alat-alat yang digunakan dalam laboratorium mikrobiologi dengan
benar.
-
Agar praktikan
mengetahui teknik penyiapan serta penggunaan alat- alat laboratorium
dengan baik.
-
Membuat alat-alat yang akan di gunakan menjadi steril agar
terhindar dari kesalahan saat melakukan percobaan
1.3.2
Inokulasi
-
Agar praktikan mengetahui
perkembangbiakan mikroba berdasarkan beberapa teknik inokulasi
-
Agar praktikan tau teknik inokulasi yang
paling sesuai dalam penumbuhan mikroba
-
Agar praktikan tau metode dan prosedur
dalam teknik inokulasi
1.4 MANFAAT PERCOBAAN
1.4.1
Sterilisasi
Manfaat dari
praktikum ini adalah Praktikan mengetahui teknik sterilisasi yang sesuai untuk
alat-alat dan bahan-bahan yang ada di laboratorium agar terhindar dari
kelasahan dalam mensterilisasikan alat-alat yang ada dan mengetahui syarat apa
saja yang membuat suatu alat layak di sterilisasikan di Autoklaf ataupun pada
Oven
1.4.2
Inokulasi
Manfaat melakukan percobaan
ini adalah praktikan mampu memahami bahwa pada penumbuhan mikroba dengan teknik
inokulasi yang terdiri dari metode gores, metode sebar dan metode tuang
menghasilkan biakan mikroba yang berbeda berdasarkan pola tumbuhnya mikroba
yang dapat diamati setalah melakukan percobaan. Selain itu dengan melakukan
percobaan teknik inokulasi ini mahaiswa mampu memahami perbedaan antara
Inokulasi dan Isolasi.
BAB
II
TINJAUAN
PUSTAKA
2.1
Sterilisasi
Bekerja di laboratorium
mikrobiologi tidak akan lepas dari berbagai kemungkinan terjadinya bahaya dari
berbagai jenis bahan kimia baik yang bersifat sangat berbahaya maupun yang
bersifat berbahaya. Selain itu, peralatan yang ada di dalam laboratorium juga
dapat mengakibatkan bahaya yang tak jarang berisiko tinggi bagi praktikan yang
sedang melakukan praktikum jika tidak mengetahui cara dan prosedur penggunaan
alat yang akan digunakan. Setiap percobaan kita selalu menggunakan peralatan
yang berbeda atau meskipun sama tapi ukurannya berbeda (Winarni, 1997)
Sterilisasi dilakukan
di dalam praktikum mikrobiologi bertujuan agar sebelum melakukan praktikum,
alat-alat yang digunakan telah ter-sterilisasi agar tidak ada mikroba yang
mengkontaminasi dalam praktikum yang akan dilakukan, karena akan sangat
berpengaruh terhadap hasil praktikum yang akan dikerjakan(Winarni, 1997).
Mikrobiologi adalah
ilmu yang mempelajari tentang mikroorganisme yang tidak dapat dilihat dengan
mata telanjang untuk meneliti apa saja yang terkandung di dalam mikroorganisme.
Dalam meneliti mikroorganisme diperlukan teknik atau cara–cara khusus untuk
mempelajarinya serta untuk bekerja pada skala laboratorium untuk meneliti
mikroorganisme baik sifat maupun karakteristiknya, tentu diperlukan adanya
pengenalan alat yang akan digunakan serta mengetahui cara penggunaan alat–alat
yang berhubungan dengan penelitian untuk memudahkan dalam melakukan penelitian
(Sumarsih, 2003).
Di
dalam pekerjaan mikrobiologi seringkali kita tidak terlepas dari alat-alat yang
berada dalam laboratorium. Untuk itu diperlukan pemahaman tentang fungsi dan
sifat-sifat dari alat yang digunakan. Peralatan yang digunakan pada
laboratorium mikrobiologi hampir sama dengan peralatan-peralatan yang umumnya
digunakan di laboratorium kimia yaitu berupa alat-alat gelas antara lain:
tabung reaksi, cawan petri, pipet ukur dan pipet volumetrik, labu ukur, labu
erlenmeyer, gelas piala, pH meter, gelas arloji, termometer, botol tetes,
pembakar spiritus, kaki tiga dengan kawat asbes dan rak tabung(Sumarsih, 2003).
Di
dalam pekerjaan mikrobiologi dibutuhkan alat yang khusus untuk melihat
mikroorganisme. Salah satu alat yang sering digunakan adalah mikroskop.
Mikroskop merupakan alat bantu yang memungkinkan kita dapat mengamati objek
yang berukuran kecil. Di samping peralatan gelas, pada laboratorium
mikrobiologi masih ada sejumlah alat yang khusus antara lain: otoklaf, oven,
mikroskop, jarum ose (inokulasi), jarum preparat, gelas objek, kaca penutup,
keranjang kawat untuk sterilisasi, inkubator untuk membiakkan mikroorganisme
dengan suhu yang konstan, spektrofotometer untuk mengukur kepekatan suspensi
atau larutan. Penangas air untuk mencairkan medium, maknetik stirrer untuk
mengaduk dan tabung durham untuk penelitian fermentasi. Alat-alat yang
digunakan dalam praktikum mikrobiologi juga harus dalam keadaan steril atau
bebas dari kumanserta bakteri, virus dan jamur. Dan untuk mensterilkannya
diperlukan pula pengetahuan tentang cara- cara / teknik sterilisasi. Hal ini
dilakukan karena alat- alat yang digunakan pada laboratorium mikrobiologi
memiliki teknik sterilisasi yang berbeda (Agus, 2006).
Sterilisasi
merupakan Metode praktis yang dirancang untuk membersihkan dari mikroorganisme,
atau sengaja untuk menghambat pertumbuhannya, yang nyata dari kepentingan dasar
di banyak keadaan. Jenis dari mikroorganisme sangat berbeda dalam kelemahannya
terdapat berbagai macam agen antimikroba, dan lebih banyak lagi, afek yang
praktis dari agen ini pada adanya keadaan nyatayang sangat besar dipengaruhi
oleh keadaan sekitar. Banyak yang akan bertahan, contohnya, pada cuaca tertentu
organisme memiliki kulit, pada beberapa tubuh zat cair atau pada udara, Air,
makanan, kotoran, atau ruangan berdebu. Caranya harus dirubah, oleh karena itu,
dengan masalah nyata. Hal ini tidak mungkin, bagaimanapun pada garis besarnya
tentunya prinsip dasar digaris bawahi pada umumnya digunakan cara untuk
memusnahkan dan mengontrol kehidupan mikroba (Sumarsih, 2003).
Pengertian
sterilisasi adalah proses pembebasan alat atau bahan baik berupa padat atau
cairan dari segala bentuk kehidupan terutama mikroorganisme.
Sterilisasi
umumnya di lakukan dengan autoklaf untuk yang menggunakan panas bertekanan.
Cara lain yang kini dikembangkan adalah sterilisasi basah untuk produk-produk
yang tidak tahan panas .
Proses
Sterilisasi
Berikut
beberpa contoh proses sterilisasi yang sering dilakukan dalam sekala praktikum
laboratorium maupun dalam sekala pabrik, diantara yaitu: berikut ini adalah
jenis proses bertekanan pada suhu 121oC selama 15 menit. Maka
sterilisasi:
a.
Sterilisasi
basah atau sterilisasi panas lembab
Sterilisasi
basah biasanya dilakukan di dalam autoklaf atau sterilisator uap yang mudah
diangkat (portable) dengan menggunakan air jenuh basah dapat digunakan
untuk mensterilkan bahan apa saja yang dapat ditembus uap air (misalnya minyak)
dan tidak rusak bila dipanaskan dengan suhu yang berkisar antara 110oC
dan 121oC. Bahan-bahan yang biasanya disterilkan dengan cara ini
antara lain medium biakan yang umum, air suling, peralatan laboratorium, biakan
yang dibuang, medium yang tercemar, dan bahan-bahan dari karet.
Ada 4 hal utama
yang harus diingat bila melakukan sterilisasi basah:
1)
Sterilisasi bergantung pada uap, karena itu udara harus dikosongkan betul-betul
dari ruang sterilisator;
2)
Semua bagian bahan yang disterilkan harus terkena uap, karena itu tabung dan
labu kosong harus diletakkan dalam posisi tidur agar udara tidak terperangkap
di dasarnya;
3)
Bahan-bahan yang berpori atau yang berbentuk cair harus permeabel terhadap uap;
4)
Suhu sebagaimana yang terukur oleh termometer harus mencapai 121oC
dan dipertahankan setinggi itu selama 15 menit
(Ratna, 1993)
b.
Sterilisasi
kering
Sterilisasi
kering atau sterilisasi panas kering dapat diterapkan dengan cara pemanasan
langung sampai merah, meayangkan di atas nyala api, pembakaran dan sterilisasi
dengan udara panas (oven). Pemanasan kering sering digunakan dalam sterilisasi
alat-alat gelas di laboratorium. Dalam sterilisasi panas kering, bahan yang
sering disterilkan adalah pipet, tabung reaksi, cawan petri dari kaca, dan
barang-barang pecah belah lainnya. Bahan-bahan yang disterilkan harus
dilindungi dengan cara membungkus, menyumbat atau menaruhnya dalam suatu wadah
tertutup untuk mencegah kontaminasi setelah dikeluarkan dari oven (Ratna,1993).
Sebelum
melakukan sterilisasi udara panas kering ini terlebih dahulu membungkus
alat-alat gelas dengan kertas payung atau aluminium foil, setelah itu atur
pengatur suhu oven menjadi 160oC dan alat disterilkan selama 2 jam.
Berikut
adalah tabel daftar suhu dan waktu yang biasa digunakan untuk sterilisasi panas
kering dengan oven:
c.
Sterilisasi
uap
Uap
panas pada suhu 100oC dapat digunakan dalam bentuk uap mengalir.
Metode ini mempunyai keterbatasan. Penggunaan uap mengalir dilakukan dengan
proses sterilisasi bertingkat untuk mensterilkan media kultur. Metode ini
jarang memuaskan untuk larutan yang mengandung bahan-bahan karena spora sering
gagal tumbuh di bawah kondisi ini, karena bentuk vegetatif dari kebanyakan
bakteri tidak membentuk spora. Temperatur suhu titik mati bervariasi, tetapi
tidak ada bentuk non spora yang bertahan. Dalam prakteknya, suatu perpanjangan
pemaparan uap selama 20-60 menit akan membunuh semua bentuk vegetatif bakteri
tapi tidak akan menghancurkan spora. Untuk meyakinkan penghancuran spora,
dilakukan sterilisasi bertingkat. Proses ii dilakukan dengan waktu yang
bervariasi, dari 20-60 menit setiap hari selama 3 hari. Setiap hari setelah
sterilisasi bahan disimpan pada inkubator pada 37oC. Prinsip dari
metode ini adalah pada saat pemaparan pertama, uap membunuh bakteri vegetatif
tapi tidak sporanya. Tapi pada saat bahan disimpan pada inkubator atau pada
suhu ruangan selama 24 jam, spora akan tumbuh ke dalam bentuk vegetatif. Spora
yang telah tumbuh ini akan dimatikan pada pemanasan hari ke dua. Kesuksesan
dari proses ini tergantung pada spora yang berkembang ke bentuk vegetatif
selama masa istirahat (Ratna,1993).
d. Penyaringan
(filtrasi)
Penyaringan
telah banyak digunakan untuk mensterilkan medium laboratorium dan larutan yang
dapat mengalami kerusakan jika dipanaskan. Penyaringan dengan ukuran pori-pori
0,45 mikron atau kurang akan menghilangkan jasad renik yang terdapat di dalam
larutan tersebut. Penyaring yang banyak digunakan terbuat dari gelas sinter,
selulsa dan asbestos atau penyaring Seitz. Pori-pori dari penyaring tersebut
berkiras antara 0,22 sampai 10 mikron. Pori-pori yang lebih kasar biasanya
digunakan untuk penjernihan sebelum digunakan pori-pori yang lebih halus,
sehingga tidak terjadi penyumbatan. Penyaring yang biasa digunakan untuk
bakteri tidak dapat menahan atau menyaring virus atau mikoplasma.Beberapa
contoh bahan yang biasa disterilkan dengan cara ini adalah serum, larutan
bikarbonat, enzim, toksin, bakteri, medium sintetik tertentu, dan antibiotik. Pori-pori
yang lebih kasar biasanya digunakan untuk penjernihan sebelum digunakan pori-pori
yang lebih halus, sehingga tidak terjadi penyumbatan (Ratna,1993).
Ada
beberapa macam filter, yaitu:
1)
Filter Swinny
Sebuah adaptasi dari filter seitz,
filter swinny mempunyai adaptor khusus yaitu terdiri dari lapisan asbes,
bersama dengan layer dan pencuci. Keutamaan untuk digunakan filter swinny
dibungkus dengan kertas dan autoklaf. Bagian yang dipotong dihubungkan pada
spoit werlock dan cairan dimasukkan ke potongan asbes dengan menggunakan
tekanan pada sal spoit.
2)
Filter Fritted-Glass
Permeabilitas dari filter
berbanding lurus dengan ukurannya. Setelah potongan dibentuk, potongan disegel
dengan pemanasan di dalam gelas pirex seperti corong buhcner.
3)
Filter Berkefeld dan Mandler
Mandler terbuat dari tanah silika
murni, asbestos dan kalium sulfat. Berkefeld juga tersusun dari tanah silika
murni. Masing-masing filter bermuatan negatif.
4)
Filter Selas
Filter ini secara kimia bersifat
resisten terhadap semua larutan yang tidak menyerang silika.
5)
Filter Candles-Pasteur-Chamberland
Terbuat dari bahan pori porselen
tak berkaca dengan pori kecil yang menghasilkan filtrasi lambat
(Sumarsih 2003).
e.
Sterilisasi
dengan desinfektan
Desinfektan
adalah zat yang dapat membunuh bakteri. Senyawa kimia yang banyak digunakan
sebagai esinfektan antara lain: larutan AgNO3, CuSO4,
HgCl2, ZnO, serta alkohol dan campurannya. Zat-zat yang dapat
membunuh atau menghambat pertumbuhan bakteri dapat dibagi atas garam-garam,
logam, fenol, dan senyawa-senyawa lain yang sejenis, formaldehida,yodium,
alkohol, klor, zat warna, detergen, sulfonamida, dan antibiotik. Umumnya
bakteri yang muda kurang daya tahannya terhadap desinfektan daripada bakteri
yang tua. Kepekatan, konsentrasi dan lamanya berada di bawah pengaruh
desinfetan merupkan faktor-faktor yang berperan dalam sterilisasi jenis ini
(Agus, 2006).
f.
Sterilisasi
gas
Sterilisasi
gas digunakan dalam pemaparan gas atau uap untuk membunuh mikroorganisme dan
sporanya. Beberapa bahan kimia yang dapat digunakan untuk sterilisasi gas
adalah etilena oksida, asam parasetat, formaldehida dan glutaraldehida alkalin.
Cara ini diterapkan pada suhu kamar selama 2-18 jam tergantung pada bahan
kimianya. Hal-hal yang perlu diperhatikan dapat sterilisasi gas antara lain:
1) Lamanya waktu yang diperlukan sesudah
perlakuan untuk menghilangkan semua sisa bahan kimia yang digunakan;
2) Daya bahan bakar yang bersangkutan;
3) Persyaratan peralatan;
4) Biaya pelaksanaan (Agus, 2006).
g.
Sterilisasi
dengan radiasi
Sterilisasi
dengan radiasi dapat dilakukan dengan sinar gamma (sinar UV kadang juga
digunakan tetapi tidak begitu baik karena daya tembusnya lemah) namun
penggunaannya terbatas karena menuntut persyaratan keamanan dan biaya tinggi
(Agus dkk, 2006).
Fungsi
Sterilisai
Tujuan
utama yaitu mematikan, menyingkirkan atau mengahambat pertumbuhan mikroorganisme
adalah :
1.
Untuk mencegah inflasi pada manusia, hewan dan tumbuhan.
3.
Untuk mencegah gangguan kontaminasi terhadap mikroorganisme.
4. Untuk mencegah
kontaminasi bahan-bahan yang dipakai
(Ratna,1993).
2.2
Inokulasi
Mikrobiologi adalah suatu ilmu yang mempelajari
makhluk hidup yang sangar kecil (diameter kurang dari 0,1 mm) yang tidak dapat
dilihat dengan mata biasa tanpa bantuan suatu peralatan khusus. Makhluk ini,
yang disebut jasad renik atau mikroorganisme, terdapat di mana-mana. Di
antaranya adayangbermanfaat bagi kehidupan manusia, tetapi banyak pula yang
merugikan seperrimisalnya yang menimbulkan berbagai penyakit. Mikrobiologi
meliputi berbagai disiplin ilmu seperti bakteriologi, imunologi, virologi,
mikologi dan parasitologi. Ilmu-ilmu ini telah berkembang dengan pesarnya dari
tahun ke tahun, sehingga merupakan disiplin-disiplin yang terpisah dan berdiri
sendiri-sendiri (Agus, 2006)
Dalam mikrobiologi, dipelajari mikroorganisme yang
ada kaitannya dengan penyakit (infeksi); dan dicari jalan bagaimana cara
pencegahan, penanggulangan serta pemberantasannya. Ilmu ini terus berkembang
tanpa hentinyakarena mikroorganisme sebagai makhluk hidup mampu menyesuaikan
diri terhadap lingkungannya yafig baru, sehingga hal ini akan tetap merupakan
rantangan bagi ilmu. SebagaiSujudi Ditemukannya jenis-jenis bakteri baru,
sifat-sifat yang baru dari bakteri dan jenis infeksi yang "keras
kepala" atav yangtidak mau sembuh semuanya ini merupakan btrkti bahwa
bakteri-bakteri tadi mampu mengadaptasikan diri terhadap lingkungannya yang
baru (Agus, 2006).
Pertumbuhan adalah penambahan secara teratur semua
komponen sel suatu jasad. Pembelahan sel adalah hasil dari pembelahan sel. Pada
jasad bersel tunggal (uniseluler), pembelahan atau perbanyakan sel merupakan
pertambahan jumlah individu. Misalnya pembelahan sel pada bakteri akan
menghasilkan pertambahanjumlah sel bakteri itu sendiri. Pada jasad bersel
banyak (multiseluler), pembelahan sel tidak menghasilkan pertambahan jumlah
individunya, tetapi hanya merupakanpembentukan jaringan atau bertambah besar
jasadnya. Dalam membahas pertumbuhan mikrobia harus dibedakan antara
pertumbuhan masing-masing individu sel danpertumbuhan kelompok sel atau
pertumbuhan populasi.( Sumarsih, 2003)
Pertumbuhan dapat diamati dari meningkatnya jumlah
sel atau massa sel (berat kering sel). Pada umumnya bakteri dapat memperbanyak
diri dengan pembelahan biner, yaitu dari satu sel membelah menjadi 2 sel baru,
maka pertumbuhan dapat diukur dari bertambahnya jumlah sel. Waktu yang
diperlukan untuk membelah diri dari satu sel menjadi dua sel sempurna disebut
waktu generasi. Waktu yang diperlukan olehsejumlah sel atau massa sel menjadi
dua kali jumlah/massa sel semula disebut doubling time atau waktu penggandaan.
Waktu penggandaan tidak sama antara berbagai mikrobia, dari beberapa menit,
beberapa jam sampai beberapa hari tergantung kecepatan pertumbuhannya.
Kecepatan pertumbuhan merupakan perubahan jumlah atau massa sel per unit
waktu.(Sumarsih, 2003)
Suatu bakteri yang dimasukkan ke dalam medium baru yang
sesuai akan
tumbuh
memperbanyak diri. Jika pada waktu-waktu tertentu jumlah bakteri dihitung dan
dibuat grafik hubungan antara jumlah bakteri dengan waktu maka akan diperoleh
suatu grafik atau kurva pertumbuhan. Pertumbuhan populasi mikrobia dibedakan
menjadi duabiakan sistem tertutup (batch culture) dan biakan sistem terbuka (continous culture). Menurut
(Agus Dkk) dalam bukunya yaitu Buku Ajar Mikrobiologi Kedokteran menyebutkan
bahwasanya bakteri terbagi menjadi beberapabentuk, diantaranya:
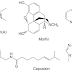
a. Kapsul
Banyak spesies bakteri mensintesa polimer ekstrasel
(pada umumnya polisakarida) yang berkondensasi dan membentuk lapisan di
sekeliling sel dan disebut kapsul. Pada medium agar, koloni bakteri berkapsul
tarnpak sebagai koloni berlendir. Ijmumnya bakteri berkapsul lebih tahan
terhadap efek fagositosis dari daya pertahanan badan. Sejenis kapsul pada
Streptococcus tnutans misalnya, dapat melekat erat pada permukaan gigi,
membentuk lapisan plaque pada gigi dan mengeluarkan produk asam yang menyebabkan
karies gigi (Agus, 2006).
b. Flagel
Flagel adalah bagian bakteri yang berbentuk seperti
benang, yang umumnya terdiri dari protein
dengan diameter 12-30 nanometer. Flagel adalah alat pergerakan. Ada tiga
jenis flagel: 1. Monotrikh: flagel tunggal dan terdapat di
bagian
ujung bakteri. 2. Lofotrikh: lebih dari satu flagel di satu bagian polar
bakteri 3. Amfitrikh: flagel terdapar saru atau lebih di kedua polar dari
bakteri 4. Peritrikh: flagel tersebar merata di sekeliling badan bakteri.
Protein dari flagel disebut flagellin. Bila suspensi bakteri berflagel kita
kocok kuatkuat, maka flagel akan rontok, tetapi flagel tersebut dapat tumbuh
lagi sempurna dalam 3-6 menit (Agus, 2006).
c. Pili
= fimbriae
Beberapa bakteri negatif Gram memiliki rambur pendek
dan keras yang disebut pili. Pili terdiri dari subunit-subunit protein. Ada dua
jenis Pili:
1,.
Pili yang memegang peranan dalam adhesi bakteri dengan sel tubuh hospes.
2.
Seks Pili yang berfungsi dalam konjugasi dua bakteri.Virulensi dari berbagai
jenis bakteri patogen tidak hanya tergantung pada toksin bakteri, tetapi jug^
tergantung pada Colonization Antigen, yangterryata adalah pili biasa. Protein M
pada Streptococcus adalah juga lapisan fimbrial yang merupakan antigen
permukaan, dan lipoteicholic acid yang ada di alamnya bertanggung jawab pada
perlekaran Streptococcus group A pada sel epitel (Agus, 2006).
d. Endospora
Beberapa genus bakteri dapat membentuk endospora.
Yang paling sering membentuk spora ada lah bakteri batang positif Gram Bacillus
gents dan Clostridium. Bakteri-bakteri ini mengadakan diferensiasi membentuk
spora bila keadaan lingkungannya menjadi jelek, misalnya bila medium di
sekitarnya kekurangan nutrisi. Masingmasing sel akan membentuk spora, sedangkan
sel induknya akan mengalami otolisis. Spora adalah bakteri dalam bentuk
istirahat. Spora bersifat sangat resisten terhadap panas, kekeringan dan zat
kimiawi. Bila kondisi lingkungan telah baik kembali spora dapat kembali
melakukan germinasi dan memproduksi sel vegetatif. Secara morfologis, proses
sporulasi terjadi dengan
c
ra isolasi badan inti yang diikuti denganmelipatnya membran sel ke arah dalam
(Agus, 2006)
Pertumbuhan diukur dari perubahan
jumlah sel atau berat kering massa sel. Jumlah sel dapat dihitung dari jumlah
sel total yang tidak membedakan jumlah sel hidup atau mati, dan jumlah sel
hidup (viable count). Jumlah total sel mikrobia dapat ditetapkan secara
langsung dengan pengamatan mikroskopis, dalam bentuk sampel kering yang
diletakkan di permukaan gelas benda (slide) dan dalam sampel cairan yang diamati
menggunakan metode counting chamber, Jumlah sel hidup dapat ditetapkan dengan
metode plate count atau colony count, dengan cara ditaburkan pada medium agar
sehingga satu sel hidup akan tumbuh membentuk satu koloni, jadi jumlah koloni
dianggap setara dengan jumlah sel. Cara ini ada dua macam, yaitu metode taburan
permukaan (spread plate method) dan metode taburan (pour plate method) (Sumarsih,
2013).
Penanaman bakteri atau
biasa disebut juga inokulasi adalah pekerjaan memindahkan bakteri dari medium
yang lama ke medium yang baru dengan tingkat ketelitian yang sangat tinggi.
Untuk melakukan penanaman bakteri (inokulasi) terlebih dahulu diusahakan agar
semua alat yang ada dalam hubungannya dengan medium agar tetap steril. Hal ini
agar menghindari terjadinya kontaminasi (Dwijoseputro,1998).
Ada beberapa
tahap yang harus dilakukan sebelum melakukan teknik penanaman bakteri
(inokulasi) yaitu :
a.
Menyiapkan ruangan
ruang tempat penanaman bakteri harus bersih dan keadannya harus steril agar
tidak terjadi kesalahan dalam pengamatan atau percobaaan di labotarium
pembuataan serum vaksin dan sebagainya. Inokulasi dapat dilakukan dalam sebuah
kotak kaca (encast) dimana udara dilewatkan dalam saringan melalui suatu jalan
agar tekena sinar ultraviolet (Pelczar, 1986).
b.
Pemindahan dengan pipet. Cara ini dilakukan dalam
penyelidikan air minum atau pada penyelidikan untuk diambil 1 ml contoh yang
akan diencerkan oleh air sebanyak 99 ml murni (Pelczar, 1986).
c.
Pemindahan dengan
kawat inokulasi Ujung kawat inokulasi sebaliknya dari platina atau nikel,
ujungnya boleh lurus juga boleh berupa kolongan yang diameternya 1-3 mm. Dalam
melakukuan penanaman bakteri kawat ini terlebih dahulu dipijarkan sedangkan
sisanya berupa tungkai cukup dilewatkan nyala api saja setelah dingin kembali
kawat itu disentuhkan lagi dalam nyala (Pelczar, 1986).
Ada
beberapa tahap yang harus dilakukan sebelum melakukan teknik penanaman bakteri
(inokulasi) yaitu:
a.
Menyiapkan ruangan
Ruang tempat penanaman bakteri harus bersih dan keadaannya
harus steril agar tidak terjadi kesalahan dalam pengamatan atau percobaan dalam
laboratorium pembuatan serum vaksin dan sebagainya/ inokulasi dapat dilakukan
dalam sebuah kotak kaca (encast) udara yang lewat dalam kotak tersebut
dilewatkan saringan melalui suatu jalan agar terkena sinar ultraviolet (Pelczar,1986).
b.
Pemindahan dengan pipet
Cara
ini dilakukan dalam penyelidikan air minum atau pada penyelidikan untuk diambil
1 ml contoh yang akan diencerkan oleh air sebanyak 99 ml murni (Pelczar,1986).
c. Pemindahan dengan kawat inokulasi
Ujung kawat inokulasi
sebaliknya dari platina taua nikel, ujungnya boleh lurus juga boleh berupa
kolongan yang diameternya 1-3 mm. Dalam melakukan penanaman bakteri kawat ini
terlebih dahulu dipijarkan sedangkan sisanya tungkai cukup dilewatkan nyala api
saja setelah dingin kembali kawat itu disentuhkan lagi dalam nyala api (Gupte,
1990).
Beberapa macam media yang digunakan untuk inokulasi yaitu:
a.
Mixed culture: berisi dua atau lebih spesies mikroorganisme
b.
Plate culture: media padat dalam petridish
c.
Slant culture: media padat dalam tabug reaksi
d.
Stap culture: media padat dalam tabung reaksi, tetapi penanamannya dengan cara
penusukkan
e.
Liquid culture: media cair dalam tabung reaksi
f.
Shake culture: media cair dalam tabung reaksi yang penanamannya dikocok.
Ada beberapa
metode untuk menginokulasi bakteri sesuai dengan jenis medium tujuannya. Pada
medium agar tegak, dilakukan metode tusuk menggunakan jarum ose. Pada medium
agar miring, dilakukan metode gores dengan menggunakan loop ose. Pada
medium dalam cawan petri, dapat digunakan metode streak plate (metode
gores), pour plate (metode tuang) atau spread plate (metode
sebar). Setelah inokulasi, dilakukan proses inkubasi, yaitu menyimpan medium
pada alat atau kontainer pada temperatur tertentu dan periode tertentu,
sehingga tercipta lingkungan yang menyediakan kondisi cocok untuk pertumbuhan
bakteri (TIM direkttorat, 2013)
Terdapat
beberapa cara atau metode untuk memperoleh biakan murni dari suatu biakan
campuran. Termasuk dua diantaranya yang paling sering digunakan adalah metode
cawan gores dan metode cawan tuang. Berdasarkan pada prinsip pengenceran dengan
maksud untuk memperoleh spesies individu, melalui anggapan bahwa setiap koloni
dapat terpisah dari satu jenis sel yang dapat diamati (Afrianto, 2004).
Biakan murni
diperlukan dalam berbagai metode mikrobiologis, antara lain digunakan dalam
mengidentifikasi mikroba. Untuk mengamati ciri-ciri kultural morfologi,
fisiologi dan serologi dibutuhkan mikroba yang berasal dari satu spesies
(Dwidjoseputro, 2005).
Karena jika penggoresan tidak dilakukan dengan baik atau medianya tergores
bahkan rusak, maka media tersebut tidak dapat digunakan lagi. Dan hanya
penggunaan penggoresan yang sempurna akan menghasilkan koloni yang terpisah.
Metode tebar setetes inokolum diletakan dalam sebuah medium agar nutrien dalam
cawan petridish dan dengan menggunakan batang kaca yang
bengkok dan steril. Inokulasi itu disebarkan
dalam medium batang yang sama dapat digunakan dapat menginokulasikan pinggan kedua untuk dapat menjamin penyebaran bakteri
yang merata dengan baik. Pada beberapa pinggan akan muncul koloni koloni yang
terpisah-pisah (Winarni, 1997).
Teknik yang
digunakan untuk menumbuhkan mikroorganisme pada media agar memungkinkannya
tumbuh dengan agak berjauhan dari sesamanya, juga memungkinkan setiap selnya
berhimpun membentuk koloni, yaitu sekelompok massa sel yang dapat dilihat
dengan mata telanjang. Bahan yang diinokulasikan pada medium disebut inokulum,
dengan menginokulasi medium agar nutrien (nutrien agar) dengan metode agar
tuang atau media agar sebar, sel-sel mikroorganisme akan terpisah
sendiri-sendiri. Setelah inkubasi, sel-sel mikroba individu memperbanyak diri
secara cepat sehingga dalam waktu 18 sampai 24 jam terbentuklah massa sel yang
dapat dilihat dan dinamakan koloni. Koloni dapat terlihat oleh mata telanjang.
Setiap koloni merupakan biakan murni satu macam mikroorganisme (Pelczar, 2007).
Suatu jenis koloni mikroba yang terpisah dari koloni campurannya akan lebih
mudah untuk diamati. Selain itu teknik untuk memisahkan dan
mendapatkan koloni tunggal serta pemeliharannya terdapat beberapa jenis.
Teknik-teknik tersebut memiliki kelebihan dan kelemahan. Beberapa
cara dapat dilakukan untuk menentukan jumlah bakteri yang terdapat pada bahan
pemeriksaan. Cara yang paling sering digunakan adalah cara penghitungan koloni
pada lempeng pembiakan (plate count) atau juga dapat dilakukan penghitungan
langsung secara mikroskopis (Burrows, 2004).
Menurut
Hadioetomo (1993), terdapat dua metode yang dilakukan untuk memperoleh biakan
murni yaitu :
A.
Metode cawan
gores
Teknik ini lebih menguntungkan jika
ditinjau dari sudut ekonomi dan waktu, tetapi memerlukan
ketrampilan-ketrampilan yang diperoleh dengan latihan. Penggoresan yang sempurna akan menghasilkan koloni
yang terpisah. Inokulum digoreskan di permukaan media agar nutrien dalam cawaan
petri dengan jarum pindah (lup inokulasi). Di antara garis-garis goresan akan
terdapat sel-sel yang cukup terpisah sehingga dapat tumbuh menjadi koloni
(Winarni, 1997). Cara penggarisan dilakukan pada medium pembiakan padat bentuk
lempeng. Bila dilakukan dengan baik teknik inilah yang paling praktis. Dalam pengerjaannya
terkadang berbeda pada masing-masing laboratorium tapi tujuannya sama yaitu
untuk membuat goresan sebanyak mungkin pada lempeng medium pembiakan (Tim Direktoran,
2013) .
Karena jika penggoresan tidak dilakukan dengan baik atau medianya tergores
bahkan rusak, maka media tersebut tidak dapat digunakan lagi. Dan hanya
penggunaan penggoresan yang sempurna akan menghasilkan koloni yang terpisah.
Metode tebar setetes inokolum diletakan dalam sebuah medium agar nutrien dalam
cawan petridish dan dengan menggunakan batang kaca yang
bengkok dan steril (Agus, 2006).
Metode ini
mempunyai dua keuntungan, yaitu menghemat bahan dan waktu. Metode cawan gores
yang dilaksanakan dengan baik kebanyakan akan menyebabkan terisolasinya
mikroorganisme yang diinginkan. Metode gores atau streak plate menggunakan
loop ose dan menggoreskannya ke permukaan medium agar dengan pola
tertentu dengan harapan pada ujung goresan, hanya sel-sel bakteri tunggal yang
terlepas dari ose dan menempel ke medium. Sel-sel bakteri tunggal ini akan
membentuk koloni tunggal yang kemudian dapat dipindahkan ke medium selanjutnya
agar didapatkan biakan murni. Prinsip metode ini yaitu mendapatkan koloni yang benar-benar terpisah
dari koloni yang lain, sehingga mempermudah proses isolasi. Cara ini dilakukan
dengan membagi 3-4 cawan petri. Ose steril yang telah disiapkan diletakkan pada
sumber isolat , kemudian menggoreskan ose tersebut pada cawan petri berisi
media steril. Goresan dapat dilakukan 3-4 kali membentuk garis horisontal
disatu cawan. Ose disterilkan lagi dengan api bunsen. Setelah kering, ose tersebut
digunakan untuk menggores goresan sebelumnya pada sisi cawan ke dua. Langkah
ini dilanjutkan hingga keempat sisi cawan tergores (Tim Direkttoran, 2013)
Teknik ini lebih
menguntungkan jika ditinjau dari sudut ekonomi dan waktu, tetapi memerlukan
keterampilan-keterampilan yang diperoleh dengan latihan. Penggoresan yang
sempurna akan menghasilkan koloni yang terpisah. Inokulum digoreskan di
permukaan media agar nutrien dalam cawan petri dengan jarum pindah (lup
inokulasi). Di antara garis-garis goresan akan terdapat sel-sel yang cukup
terpisah sehingga dapat tumbuh menjadi koloni (Winarni, 1997).
Dua macam
kesalahan yang umum sekali dilakukan ialah tidak memanfaatkan permukaan medium
dengan sebaik-baiknya untuk digores sehingga pengenceran mikroorganisme menjadi
kurang lanjut dan cenderung untuk menggunakan inokulum terlalu banyak sehingga
menyulitkan pemisahan sel-sel yang digoreskan (Ratna, 1990).
Cara penggarisan
dilakukan pada medium pembiakan padat bentuk lempeng. Bila dilakukan dengan
baik teknik inilah yang paling praktis. Dalam pengerjaannya terkadang berbeda
pada masing-masing laboratorium tapi tujuannya sama yaiitu untuk membuat
goresan sebanyak mungkin pada lempeng medium pembiakan (Irianto, 2006).
B.
Metode
Tebar
Setetes inokulum
diletakkan dalam sebuah medium agar nutrien dalam cawan petri dan dengan
menggunakan batang kaca yang bengkok dan steril. Inokulasi itu disebar dalam
medium betang yang sama dapat digunakan menginokulasikan pinggan kedua untuk
dapat menjamin penyebaran bakteri yang merata dengan baik. Pada beberapa
pinggan akan muncul koloni yang terpisah-pisah(Winarni, 1997).
Metode sebar
atau spread plate dilakukan dengan menyemprotkan suspensi ke atas medium
agar kemudian menyebarkannya secara merata dengan trigalski. Dengan ini
diharapkan bakteri terpisah secara individual, kemudian dapat tumbuh menjadi
koloni tunggal. Teknik spread plate (cawan sebar) adalah suatu teknik di
dalam menumbuhkan mikroorganisme di dalam media agar dengan cara menuangkan
stok kultur bakteri atau menghapuskannya di atas media agar yang telah memadat,
sedangkan pour plate kultur dicampurkan ketika media masih cair (belum
memadat). Kelebihan teknik ini adalah mikroorganisme yang tumbuh dapat tersebar
merata pada bagian permukaan agar (TIM direktorat, 2013)
Cara lain untuk
memperoleh koloni murni dari populasi campuran mikroorganisme adalah dengan
mengencerkan 125pecimen dalam medium agar yang telah dicairkan dan didinginkan
( ±50 oC ) yang kemudian dicawankan. (Winarni, 1997).
C.
Metode Tuang
Metode tuang
atau pour plate dilakukan dengan 2 cara, yaitu dengan mencampur suspensi
bakteri dengan medium agar pada suhu 50ºC kemudian menuangkannya pada cawan
petri atau dengan menyemprotkan suspensi pada dasar cawan petri, kemudian
menuang. Medium agar dan diaduk. Setelah agar mengeras, bakteri akan berada
pada tempatnya masing-masing dan diharapkan bakteri tidak mengelompok sehingga
terbentuk koloni tunggal. Isolasi menggunakan media cair dengan cara
pengenceran. Dasar melakukan pengenceran adalah penurunan jumlah mikroorganisme
sehingga pada suatu saat hanya ditemukan satu sel di dalam tabung (TIM
direkttorat, 2013).
D.
Metode Tusuk
Salahsatu metode
lain yang sering digunakan ialah metode tusuk dimana alat yang digunakan berupa
jarum ose memiki perbedaan didalam metode tusuk ini. Untuk jamur maka digunakan
kawat Ose yang bebentuk batang sedangkan untuk bakteri dugunakan kawat Ose
berbentuk bulat (TIM Direkttrorat, 2013)
BAB
III
METODE
PERCOBAAN
3.1.
ALAT
Alat yang
digunakan pada percobaan ini adalah:
3.1.1.
Sterilisasi
- Autoklaf (Express)
-
Batang
Pengaduk
- Beaker Glass (Pyrex)
- Botol Akuades
- Botol Semprot
- Cawan petri (Pyrex)
- Erlenmeyer (Pyrex 250ml)
- Gelas Ukur (Pyrex)
- Kompor (miyako)
- Lampu Bunsen
- Lemari Pendingin dilenkapi Freezer
- Rak Tabung Reaksi
- Tabung Reaksi
3.1.2.
Inokulasi
- Autoklaf (Express)
- Batang L
- Beaker Glas (Pyrex)
- Cawan Petri (Pyrex)
- Gelas Ukur (Pyrex)
- Inkubator (Mammert)
- Kompor (Miyako)
- Lampu Bunsen
- Ose
- Pipet mikro (Eppendorf)
- Rak Tabung Reaksi
- Tabung Reaksi
3.2.
BAHAN
Bahan yang
digunakan pada percobaan ini adalah:
3.2.1.
Sterilisasi
- Akuades Steril
- Etanol 70%
- Spiritus KOH
3.3.3.
Inokulasi
- Aquades
- Etanol 70%
- Media nutrient agar (NA)
3.3.
FLOWSHEET
3.3.1.
Sterilisasi
BAB
IV
HASIL
DAN PEMBAHASAN
4.1.
HASIL
4.1.1.
Sterilisasi
NNo
|
Jenis
sterilisasi
|
Alat
yang digunakan
|
Alat
yang disterilkan
|
Suhu
º C/ waktu
|
1
1
|
Basah
|
Autoklaf
|
Tabung
reaksi, labu, erlenmeter, jarum ose
|
121ºC/
15 menit
|
22
|
Kering
|
Oven
|
Cawan petri
|
170ºC/
1 jam
|
4.1.2.
Inokulasi
4.2.
PEMBAHASAN
4.2.1.
Sterilisasi
Beberpa
contoh proses sterilisasi yang sering dilakukan dalam sekala praktikum
laboratorium maupun dalam sekala pabrik, diantara yaitu Sterilisasi Kering Sterilisasi
kering atau sterilisasi panas kering dapat diterapkan dengan cara pemanasan
langsung, melayangkan di atas nyala api, pembakaran dan sterilisasi dengan
udara panas (oven)
Api digunakan untuk mensterilisasi peralatan
seperti jarum inokulasi, cawan petri, kaca objek, pinset, mulut tabungbiakan,
spatel dan lain-lain. Sesudah disterilkan peralatan tersebut harus didinginkan
terlebih dahulu sebelum dipergunakan, khusus untuk jarum inokulasi dan pipet
setelah dipijarkan atau dipanaskan di atas api, selanjutnya didinginkan dalam
larutan alkhol 70% kemudian dibakar kembali untuk menghilangkan sisa alkohol,
setelah itu dinginkan lagi di dalam larutan alkhol dan
dibiarkan/diangin-anginkan dan tidak perlu dibakar lagi.
Sterilisasi
kering merupakan sterilisasi dengan udara panas. Alat yang digunakan adalah
oven. Cara ini umum dilakukan untuk mensterilkan peralatan gelas seperti cawan
petri, tabung reaksi, dan alat-alat gelas lainnya. Prinsip kerja dari alat ini
lebih sederhana yaitu pintu oven dibuka dan semua alat-alat yang akan
disterilkan disusun rapi. Setelah itu pintu oven ditutup, suhu diseting pada
angka 160-180oC selama 1-2 jam. Keuntungan dari pemanasan kering adalah tidak
adanya uap air yang membasahi bahan atau alat yang disterilkan pada percobaan ini alat-alat kualitatif
disterilisasikan dengan metode sterilisasi kering.
Sterilisasi
basah atau sterilisasi panas lembab dapat diterapkan dengan cara pemanasan
menggunakan uap air dengan tekanan(autoklaf) pada suhu yang tinggi, sterilisasi
basah ini biasanya digunakan pada alat-alat yang tidak tahan panas, pada
sterilisasi basah ini menggunakan suhu 120C selama 30 menit pada autoklaf
digital pada percobaan ini alat-alat kuantitatif yang bersifat pengukuran dan
bahan yang tidak tahan terhadap pemanasan tinggi di starilisasikan dengan
metode panas basah ini.
4.2.2.
Inokulasi
Teknik
inokulasi dapat dilakukan dengan metode gores pada agar datar (streak plate
method), Tuang maupun sebar . Proses inokulasi harus benar-benar aseptik atau
steril supaya tidak terjadi kontaminasi oleh mikroorganisme lain. Pada hasil
pengamatan terlihat adanya bercak putih baik itu pada metode gores, sebar
maupun tuang menandakan dalam waktu 24jam inkubasi didalam Autoklaf bakteri
mampu berkembang biak Waktu yang diperlukan untuk membelah diri dari satu sel
menjadi dua sel sempurna disebut waktu generasi. Waktu yang diperlukan
olehsejumlah sel atau massa sel menjadi dua kali jumlah/massa sel semula
disebut doubling time atau waktu penggandaan. Waktu penggandaan tidak sama
antara berbagai mikrobia, dari beberapa menit, beberapa jam sampai beberapa
hari tergantung kecepatan pertumbuhannya. Kecepatan pertumbuhan merupakan
perubahan jumlah atau massa sel per unit waktu.(Sumarsih 2003)
Dari semua teknik yang ada dalam inokulasi, pastilah
ada kurang dan lebihnya dari tiap teknik tersebut dimana mengingat berbeda cara
berbeda pula penggunaan dan penempatan pemakaiannya. Adapun berdasarkan hasil
yang didapat teknik yang lebih menguntungkan adalah teknik gores, Teknik
ini lebih menguntungkan jika ditinjau dari sudut ekonomi dan waktu, tetapi
memerlukan keterampilan-keterampilan yang diperoleh dengan latihan. Penggoresan
yang sempurna akan menghasilkan koloni yang terpisah. Inokulum digoreskan di
permukaan media agar nutrien dalam cawan petri dengan jarum pindah (lup
inokulasi). Di antara garis-garis goresan akan terdapat sel-sel yang cukup
terpisah sehingga dapat tumbuh menjadi koloni (Winarni, 1997).
BABV
KESIMPULAN DAN SARAN
KESIMPULAN DAN SARAN
5.1.
KESIMPULAN
5.1.1
Sterilisasi
-
Agar praktikan
mengetahui teknik sterilisasi alat-alat yang digunakan dalam laboratorium mikrobiologi dengan
benar.
Dalam
sterilisasi terdapat dua metode yang umum yaitu sterilisasi panas lembab atau
basah dan sterilisasi kering. Sterilisasi basah dilakukan didalam autoklaf yang
mudah diangkat. Sterilisasi basah digunakan untuk mensterilkan bahan apasaja
yang dapat ditembus uap airdan tidak rusakbila dipanaskan dengan suhu yang
berkisar antara 110C dan 121C biasa digunakan untuk alat yang bersifat
kuantitatif sedangkan sterilisasi kering sering digunkan untuk sterilisasi
alat-alat gelas di laboratorium yang tahan akanpemanasan dan sering
digunakanuntuk mensterilkan alat-alat yang bersifat kualitatif saja(Ratna,
1993)
-
Agar praktikan
mengetahui tujuan utama dilakukan sterilisasi
Sterilisasi
dilakukan dalam praktikum mikrobiologi bertujuan agar sebelum melakukan
praktikum, alat-alat yang digunakan telah tersteriisasi agar tidak ada mikroba
yang mengkontaminasi dalampraktikum yang akan dikerjakan(Winarni 1997)
-
Membuat alat-alat yang akan di gunakan menjadi steril agar
terhindar dari kesalahan saat melakukan percobaan
Setelah dikakukan
sterilisasi dengan metode yang sesuai dan dengan prosedur yang semestinya dapat
dipastikan bahwa alat-alat yang telah di sterilisasi sudah bisa dikatan steril
dengan syarat pada saat pengeluaran barang dari Oven ataupun Autoklaf di
usahakan agar tidak kontak langsung dengan udara luar makadari itu alat-alat
sebaiknya dibungkus dengan kertas dan tidak dibuka sebelum alat akan digunakan
5.1.2
Inokulasi
- Agar
praktikan mengetahui perkembangbiakan mikroba berdasarkan beberapa teknik
inokulasi
Setelah melakukan
pengamatan terhadap hasil inkulasi dengan tiga metode yang berbeda dapat
dilihat bahwa metode gores merupakan metode dengan biakan mikroba dengan koloni
yang terpisah. Halini sesuai dengan pernyataan Winarni (1997) bahwa “Diantara
garis-garis goresan akan terdapat sel-sel yang cukupterpisah sehingga dapat
tumbuhmenjadi koloni”.
- Agar
praktikan tau teknik inokulasi yang paling sesuai dalam penumbuhan mikroba
Pada dasarnya metode
inokulasi memiliki keunggulan tersendiri dari yang lainnya walaupun tujuan dari
inokuasi sama yaitu membentuk koloni mikroorganisme yang terpisah pada media
yang sesuai. Pada proses ALT misalnya, digunakan ,metode tuang walaupun metode
gores lebih unggul pada hasil pengamatan biakan koloni di praktikum teknik inokulasi
namun pada ALT justru prinsip dari teknik inokulasi tuanglah yangdibutuhkan.
- Agar
praktikan tau metode dan prosedur dalam teknik inokulasi
Metode yang diterapkan
dalam inokulasi tidak jauh berbeda antara satu dengan liannya hanya saja
perbedaan terletak pada titik penanaman sampel pada media. Di metode gores
sampel hanya digores diatas media tidak di ratakan seperti halnya metode sebar
dimana sampel(inokulum) di sebar merata pada permukaanmedia. Sedangkan metode
tuang, sampel diletakkan didasar media hal ini akan cocok denganbeberapa tujuan
tertentu misalnya untuk meliat pertumbuhan bakteri aerob mesofil pada uji angka
lempeng total.
5.2.
SARAN
- Sebaiknya seluruh praktikum di perhatikan dan dilakukan
dengan seksama oleh praktikan. Karna antara satu judul praktikum dan judul
lainnya memiliki kaitan yang erat.
- Dalam percobaan kali ini Praktikan sangat mengharapkan
petunjuk dari asisten agar berhati-hati dalam melakukan praktikum. Mengingat
bahan percobaan yang mengandung mikroba yang bisa saja mengkontaminasi dan
mengganggu kesehatan
- Sebaiknya setiap tindakan dalam melakukan praktikum
diarahkan langsung kepada praktikan agar praktikan bisa memahami berbagai
teknik dalam laboratorium berkaitan dengan judul yang di praktekkan.
DAFTAR PUSTAKA
Sumarsih, Sri. (2003). Mikrobiologi Dasar. Yogyakarta: Jurusan
Ilmu Tanah UPN
Syahputra, Surya edma. (2012). Inokulasi
dan Pemurnian bakteri. Laporan
Praktikum Mikrobiologi
Praktikum Mikrobiologi
Direktorat
Pembinaan Sekolah Menengah Kejuruan. (2013). Mikrobiologi.
Jakarta:Kemdikbud.
Jakarta:Kemdikbud.
Aminah, Aan et al.
(2013). Penanambiakan Inokulasi. Bandung
Syahrurahman,
Agus et al. Mikrobiologi Kedokteran.
Tanggerang: Binakarya
Aksara
Aksara
Saya sediakan juga format PDFnya silahkan di download DISINI






0 comments:
Post a Comment
Silahkan tambahkan komentar teman-teman, diharapkan menggunakan kata-kata yang pantas. karna kata-kata menunjukkan siapa kita